ビジネスモデル
レナサイエンスの研究開発の特徴
① 多様なモダリティ開発(医薬品、医療機器、プログラム医療機器)
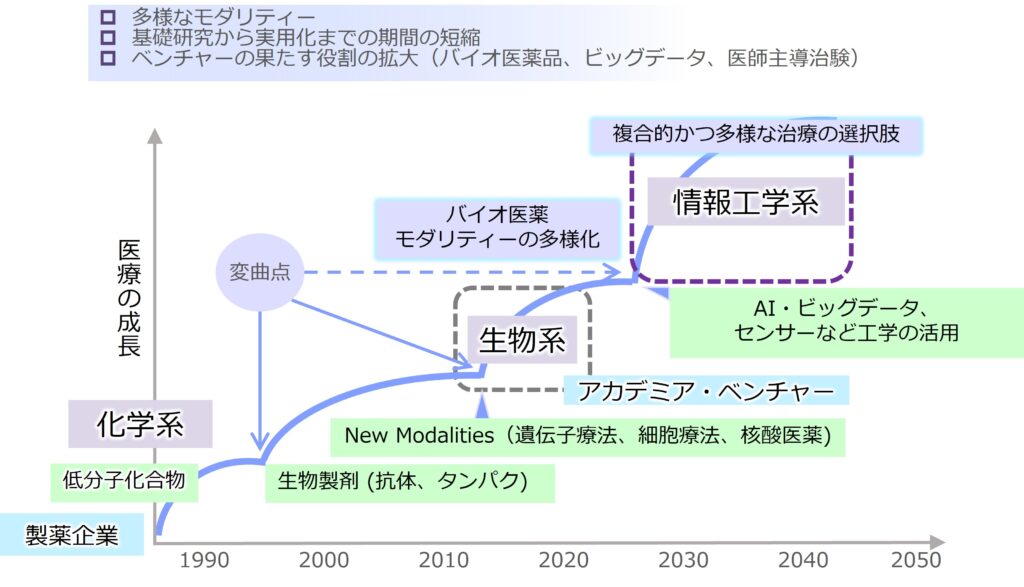
当社は医療課題を解決し、ヒトが心身共に生涯にわたって健康を享受できるための新しい医療を創造したいと考えています。医薬品開発も、低分子医薬品から、バイオ医薬品(抗体医薬、核酸医薬、遺伝子治療、細胞治療)など多様なモダリティに拡大しています。さらに近年の工学系や情報系技術の進歩により、工学・情報技術との融合による新たな医療への転換を迎えております。医薬品、医療機器、さらには人工知能(AI)を活用したプログラム医療機器など、医療での治療オプションも広がりつつあります。そのため、化学系や生物系の研究に加えて、工学系や情報系の研究にも視野を広げ、多彩で魅力ある研究と事業のポートフォリオを創出しています。
② 少子高齢化の医療課題に取り組む
日本を含む先進国では超高齢化が進み、平均寿命と健康寿命(心身ともに健康で自立して生活できる期間であり、平均寿命から寝たきりや認知症などの介護状態の期間を差し引いた期間)の差が約10年あることが大きな課題となっています。加齢と共に生じる種々の疾患、例えば、がん、循環器疾患、呼吸器疾患、糖尿病などを治療できれば、健康寿命の延伸に繋げることができます。これら4疾患は全世界の死亡者数の70-80%に至り、世界保健機関(WHO)でも老化や生活習慣に伴う重要な疾患『非感染性疾患(NCDs)』として位置付けられています。当社は、これら4疾患の治療薬を含めた健康寿命を伸ばすための医薬品、女性・小児の疾患治療薬など医学的あるいは社会的にも重要な課題を解決すべく取り組んでいます。

③ 公的研究機関や医療機関とのネットワーク
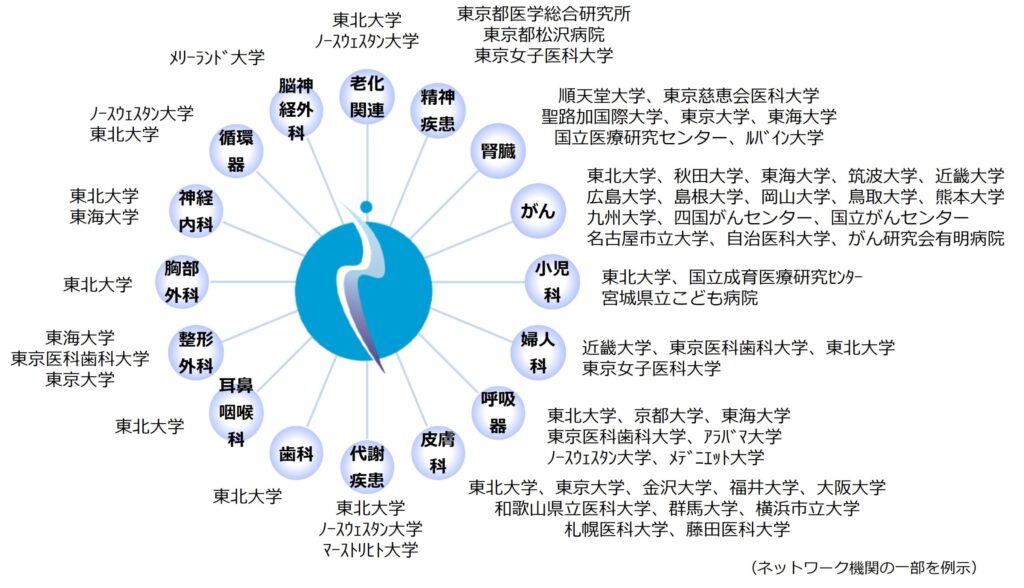
医療イノベーション創出における大学など公的研究機関や医療機関の役割も広がりつつあります。従来の低分子医薬品と異なり、遺伝子工学等を利用したバイオ医薬品の基盤技術やシーズは公的研究機関にあります。また、人工知能(AI)を活用したプログラム医療機器の開発に必要な医療ビッグデータは医療機関が有しています。当社は、多くの医療機関の診療科と複数の医師主導治験を実施しているために、医療課題の把握やAI開発に必要な医療データにアクセスしやすい環境にあります。当社は自社のリソースや研究環境にこだわるのではなく、むしろ外部リソースや外部環境(公的研究機関や医療機関とのネットワーク)を積極的に活用することにも注力し、効率的にイノベーションを創出する枠組みを構築したいと考えています。
④基礎研究から医師主導治験まで一気通貫での開発
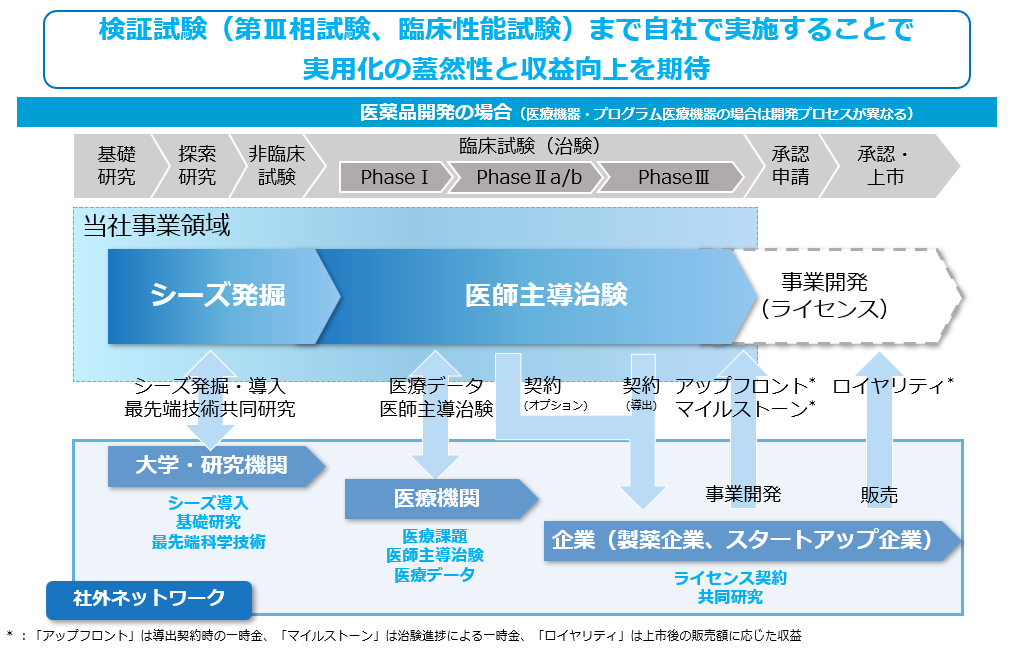
当社は、基礎研究から治療のコンセプトやアイデアを着想し、医薬品、医療機器などの「モノづくり」を行っています。適切な非臨床試験(動物試験)を終了し、最終的にヒトでの臨床試験(治験)で実証し、承認申請に近いところまで自社で開発したいと考えます。例えば、2022年12月に承認を得た医療機器である極細内視鏡は、製品開発から非臨床試験の実施、医師主導治験の終了まで複数の大学と共同で開発を進め、医療機器企業に導出後に承認申請を行いました。また、血液がんの一種である慢性骨髄性白血病の治療薬は、承認申請に必要な最後の臨床試験である第Ⅲ相試験を実施中ですが、今後も希少疾患などの領域では第Ⅲ相試験まで自社で実施したいと考えています。人工知能(AI)を活用したプログラム医療機器も、薬事承認のための臨床性能試験は自社で実施しています。自社で承認に近いところまで開発することで、確実に重要なシーズを社会実装することが可能です。また、開発ステージが後期段階で導出した方が、当社の受け取る対価も大きくなるので、株主の皆様にも還元出来ると考えます。
⑤医師主導治験の活用
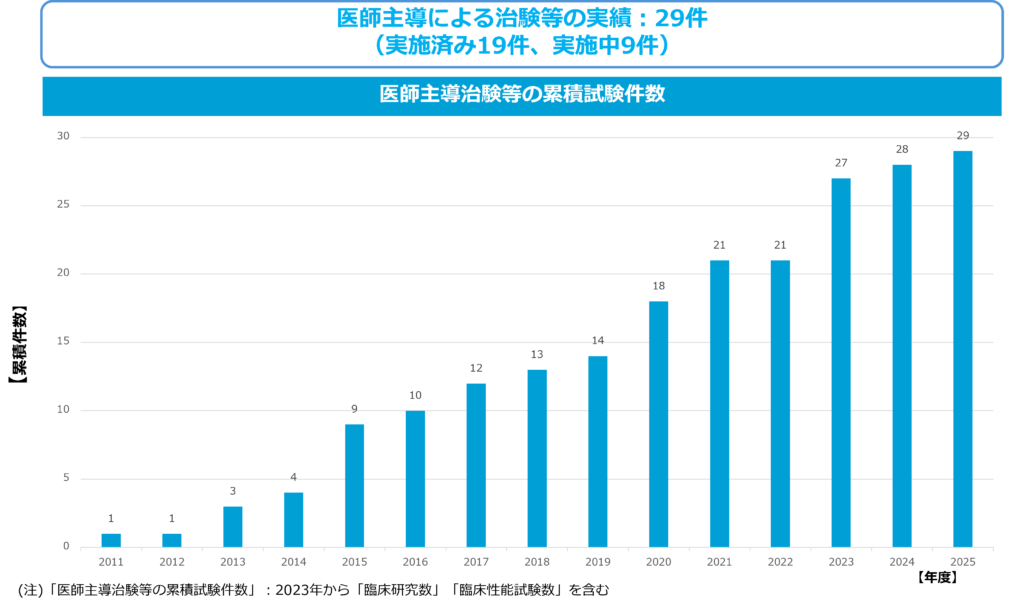
当社は、研究者でありかつ医師であるphysician scientistによる医師主導治験でこれまで29件実施しています。医師主導治験の圧倒的な利点は、「質」と「スピード」、すなわち「効率」です。医師主導治験では、最新の研究成果に触れることが可能な研究の最前線にいて、医療現場では患者を日々診療している医師が、適切な患者対象と試験計画を立案することができます。医師自ら治験を実施できるので、未承認薬の初期段階の治験(有用性や安全性を最初に確認する段階で、探索的臨床試験と言われる)には、適した治験の枠組みです。また、オーファン疾患(希少疾患のこと。患者数が少ないので売上も多くを望めない。)の治療薬開発は、収益性が低いために製薬企業が着手しないことから、最初から最後まで医師主導治験で行わざるを得ない場合もあります。医薬品開発費用のほぼ大半は、基礎研究段階では無く、臨床開発段階で費やされるものです。医師主導治験は、最先端の大学等の科学技術成果を速やかに活用でき、治療の対象となる患者を治験実施医師が適切に選択できることから、開発コストを削減できます。適切な治験調整医師を見出し、大学など複数の大きな医療機関の支援を得られた場合、企業治験に比べて医師主導治験は大きなアドバンテージがあり、短期間に大型の治験も実施できます。
2003年の薬事法改正によって、医師自らが治験を実施する医師主導治験の道が開けましたが、治験に必要な医薬品を安全性試験、製剤を含めて全て自ら準備することは依然として難しい状況です。法改正当時は、海外承認国内未承認の新薬や適応外使用薬(いわゆるドラッグラグ)も数多く存在したので、国内未承認薬や適応外使用薬が医師主導治験の主流でした。治験の実施し易さ(製造から安全性試験など既存のデータで対応可能)という点からも、多くの大学等の医療機関の医師が海外承認(国内未承認)の新薬や適応外使用薬の治験を医師主導で取り組みました。また、製薬企業が取り組まない希少疾患を対象に既存医薬品を用いて医師主導治験として実施される場合もありました。そのような背景から、「医師主導治験は海外承認薬(国内未承認)や既存薬の適応拡大やオーファン疾患が対象」という印象がいまだに強いのだと思います。しかし、当社が行う治験は全て未承認の薬剤(first-in-human)を対象としており、海外承認(国内未承認)薬や既存薬の適応拡大のための治験ではありません。当社の医薬品開発においては、非臨床試験はGLP(Good Laboratory Practice、医薬品の安全性の実施に関する基準)、治験薬の製造は治験薬GMP(Good Manufacturing Practice、治験薬の製造管理及び品質管理に関する基準)を遵守して実施しています。また、医師主導治験は、企業治験と同様にGCP(Good Clinical Practice、医薬品の臨床試験の実施に関する基準)を遵守して実施しています。そのため、承認申請や許認可を得る上で使用することができます。また、当社の医薬品は未承認の薬剤で知財も確保していますので、独占的な事業化が可能です。
⑥オープンイノベーションに基づくエコシステムの形成
これまでの製薬企業や創薬ベンチャーの多くはパイプラインのバリューチェーン(開発の全ての工程を積み上げていく)を自社で全て構築し、事業価値を高めることに注力してきました。しかし、医薬品のように成功確率が極めて低く、開発期間が長く、投資が大きな分野では研究開発及び事業リスクが大きいため、多くのパイプラインを組み合わせたポートフォリオを形成し、リスク分散をすることが不可欠です。当社は外部機関(研究機関、医療機関)のリソースを活用し、コストを含めた開発効率を高めるための開発を実践してきました。外部機関とのアライアンスをもとに多くのバリューチェーン構築を考えており、既存ベンチャーとは戦略、研究開発、人的資源管理などが異なります。少ない人的リソースや経費で多くのパイプラインを広げ、モダリティも展開できていますので、成果も出つつあります。自己資源や社内環境のみに注力するのではなく、むしろ外部資源や外部環境の積極的活用に注力し、効率的にイノベーションを創出する枠組みを構築していきたいと考えます。
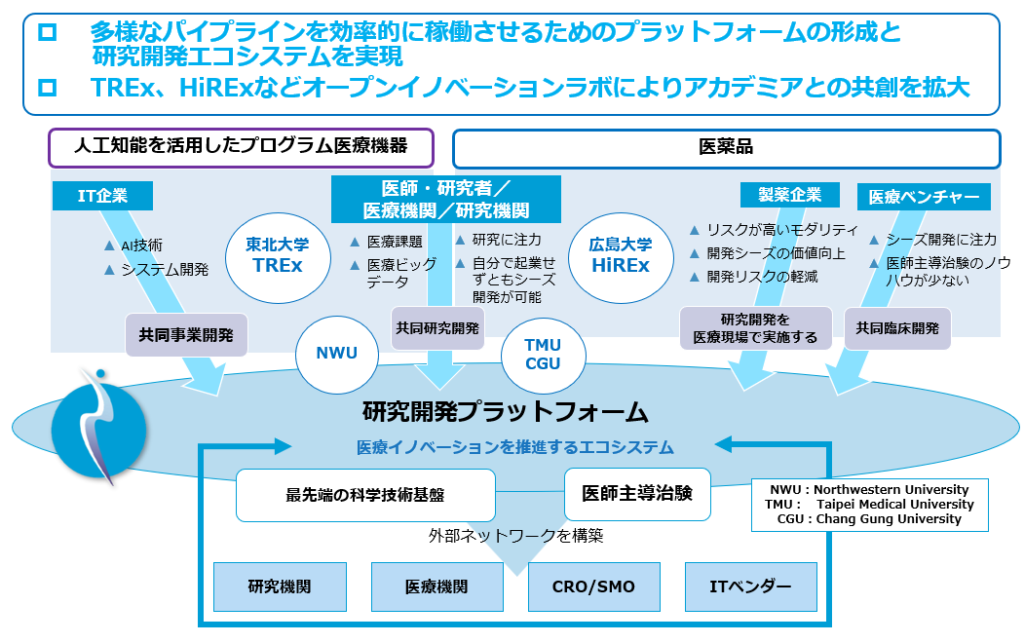
⑦レナサイエンスオープンイノベーションラボ(REx)開設による複数大学との包括的共同研究推進
多くの疾患領域に対する最先端の科学技術成果の活用の「場」、医師や研究者とのFace to Faceの交流の「場」、行政や医療産業企業とのオープンイノベーションの「場」が必要であると考え、2022年1月東北大学大学院医学系研究科メディシナルハブ(宮城県仙台市青葉区星陵町2−1 医学部5号館)に東北大学レナサイエンスオープンイノベーションラボ(TREx)を開設しました。TRExは2021年4月に締結された「仙台市と東北大学との地域経済発展に関する協定」に基づく拠点立地の第一号案件でもあります。また、2023年4月に広島大学と包括的連携協定を締結し、広島大学レナサイエンスオープンイノベーションラボ(HiREx)を開設しました。2024年10月には、台湾医科大学の100%子会社であるTaipei Medical University(TMU)-Biotech社と医薬品およびプログラム医療機器の共同研究契約を、2025年1月にはノースウエスタン大学Potocsnak Longevity Institute(長寿研究所)と長寿研究のための研究室をTREx内に設立することを合意しました。今後も国内外の最先端研究に携わる多くの公的研究機関とオープンイノベーションに基づく共同研究を展開して参ります。

